- Óxidos:
-Nomenclatura sistemática: se simplifica las valencias.
-Nomenclatura stock: donde se indica el número de oxidación del elemento oxidado, con números romanos.
-Nomenclatura Tradicional (se utiliza para óxidos básicos, no los óxidos ácidos)
- Peróxidos:
Los peróxidos son sustancias que presentan un enlace oxígeno-oxígeno y que contienen el oxígeno en estado de oxidación −1. Generalmente se comportan como sustanciasoxidantes.
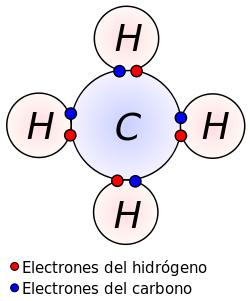
- Hidruros:
- Se formulan escribiendo primero el símbolo del hidrógeno y después el del elemento. A continuación se intercambian las valencias. Los elementos flúor, cloro, bromo y yodo se combinan con el hidrógeno con valencia 1, y los elementos azufre, selenio y telurio lo hacen con valencia 2.
- Se nombran añadiendo la terminación uro en la raíz del nombre del no metal y especificando, a continuación, de hidrógeno.
-Sales binarias:
Las sales neutras o binarias son las combinaciones binarias entre un metal y un no metal que en la tabla periódica se pueden distinguir, los metales están situados a la izquierda de la raya negra y los no metales a la derecha.
Tradicional
Se pone primero el nombre del no metal, seguido de la palabra uro. A continuación se coloca el nombre del metal terminado en ico. Si el metal tiene dos valencias se emplea la terminación oso para la meor e ico para la mayor.
Sistemática
Se empieza poniendo el nombre del no metal acabado en uro, pero se añaden dos prefijos (que son los números pequeños lo único que escritos), que indican el número de átomos del metal y del no metal que intervienen en la formula
Stock
Es la más utilizada para nombrar estos compuestos. Se nombra de manera similar a la tradicional: se escribe primero el nombre del no metal terminado en uro y después la perposición de y por último el nombre del metal, indicando su valencia en números romanos y entre parentesis.
- Hidróxidos:
Los hidróxidos son un grupo de compuestos químicos formados por un metal y uno o variosaniones hidroxilos, en lugar de oxígeno como sucede con los óxidos.
- Oxoácidos:
Los ácidos oxoácidos u oxiácidos son compuestos ternarios formados por un óxido no metálico y una molécula de agua.
Su fórmula responde al patrón HaAbOc, donde A es un no metal o metal de transición.
La forma más simple de formar una oxisal es generando el oxoanión a partir del oxiácido correspondiente, de la siguiente forma:
El anión resulta por eliminación de los hidrógenos existentes en la fórmula del ácido. Se asigna una carga eléctrica negativa igual al número de hidrógenos retirados, y que, además, será la valencia con que el anión actuará en sus combinaciones.
Los aniones se nombran utilizando las reglas análogas que las sales que originan.